Download Disini Makalahnya lebih Rapi dan Lengkap Dengan Gambar
Tusfiles
Note :- Cara Download Tunggu Selama 5 Detik Kemudian Klik Skip di Pojok Kanan
- Jika Link Download Buku tidak aktif lagi silahkan PM Admin di email shirosora02@gmail.com maupun difacebook facebook.com/shirosora
BAB
I
PENDAHULUAN
1.1 Latar
Belakang
Sistem periodik kimia adalah tampilan unsur-unsur kimia yang tertera dalam
tabel. Jumlah unsur yang terdapat pada tabel sistem periodik adalah sebanyak
118 unsur. Jumlah unsur yang terdapat di alam lebih dari 118 unsur. Hal ini
disebabkan karena atom-atom dapat bereaksi antara satu atom dengan atom yang
lain membentuk substansi baru yang disebut dengan senyawa. Bila dua atau lebih
atom-atom berikatan dan membentuk ikatan kimia menghasilkan senyawa yang unik
yaitu memiliki sifat kimia dan sifat fisika yang berbeda dari sifat asalnya
(sifat dari unsur-unsur sebelum bereaksi).
Ada beberapa hal yang kita dapat perhatikan, yaitu terdapat banyak
contoh penerapan unsur unsur kimia dalam kehidupan sehari
hari.
Salah satunya contohnya adalah air. Air merupakan materi yang
penting bagi kehidupan. Sebagian besar kebutuhan pokok kita menggunakan air.
Bahkan dalam tubuh, air penting untuk menjaga DNA dari kerusakan, mengantarkan
nutrisi ke seluruh bagian tubuh, dan menjaga keseimbangan suhu tubuh. Kita
mengetahui air memiliki rumus senyawa H2O. Air tersusun dari unsur-unsur
hidrogen dan oksigen. Tanpa kita sadari bahwa kita sedang berhadapan dengan
contoh aplikasi dari unsur-unsur yang berikatan, yang kemudian membentuk
senyawa. Mungkin hal-hal yang sepatutnya kita kritisi
adalah bagaimana unsur-unsur tersebut dapat berikatan dan
kemudian membentuk senyawa. Sebelum itu, kita harus mengetahui terlebih
dahulu apa pengertian dari senyawa kimia.
Senyawa kimia terbentuk dari dua atau lebih atom yang bergabung
atau berikatan satu sama lain. Penggabungan ini akan menghasilkan
molekul atau senyawayang sederhana atau kompleks. Atom-atom tersebut terikat
satu sama lain dalam senyawa akibat adanya gaya ikatan kimia. Munculnya teori
tentang ikatan kimia disebabkan oleh keberadaan golongan unsur gas mulia yaitu
pada golongan VIIIA pada sistem periodik.
Golongan unsur gas mulia memperlihatkan kecenderungan
yang sangat kecil untuk membentuk senyawa kimia, hal ini disebabkan karena
unsur gas mulia bersifat stabil, sangat sulit bereaksi dengan unsur lain
membentuk senyawadan memiliki elektron valensi oktet dan duplet. Kebanyakan
unsur-unsur di alam ada dalam bentuk senyawanya, bukan sebagai unsur bebas
seperti unsur gas mulia. Halini memperlihatkan adanya kecenderungan dari
atom-atom yang relatif tidak stabil membentuk senyawa yang lebih stabil
dibandingkan dengan atom unsur bebasnya.Oleh karena itu, sangat penting bagi
kita untuk dapat mengetahui dan mempelajari tentang ikatan kimia. Karena dalam
kehidupan sehari-hari, kita tidakakan pernah lepas dari hal-hal yang
berhubungan dengan ikatan kimia.
1.2
Rumusan Masalah
Dari latar belakang yang ada dapat disimpulkan bahwa rumusan masalah yang
terjadi adalah :
1.
Apa pengertian ikatan
kimia ?
2.
Apa pengertian ikatan
valensi?
3.
Apa pengertian
hibridisasi?
4.
Bagaimana teori tolakan
pasangan elektron kulit valensi tersebut?
1.3
Tujuan
Karena adanya rumusan masalah yang terjadi, maka dapat di tuliskan tujuan
nya sebagai berikut :
1.
Untuk mengetahui
pengertian ikatan kimia
2.
Untuk mengetahui
pengertian ikatan valensi
3.
Untuk mengetahui
pengertian hibridisasi
4.
Untuk memahami teori
tolakan pasangan elektron kulit valensi tersebut
BAB II
PEMBAHASAN
2.1
Ikatan
Kimia
1. Pengertian Ikatan Kimia
Sifat
terpenting yang dimiliki oleh hampir semua jenis atom adalah kemampuan
bergabung dengan atom lain untuk membentuk senyawa, dalam setiap senyawa
atom-atom terjalin secara terpadu oleh suatu bentuk ikatan antar atom yang
disebut ikatan kimia.
Ikatan kimia
terbentuk karena unsur-unsur cenderung membentuk struktur elektron stabil. Dalam
tahun 1916 telah dikenal dua macam ikatan yaitu ikatan ionik yang dikemukakan
oleh Walher Kossel (Jerman) dan ikatan kovalen, oleh G.N. Lewis (Universitas
California). Walter
Kossel dan Gilbert Lewis pada tahun 1916 menyatakan
bahwa terdapat hubungan antara stabilnya gas mulia dengan cara atom berikatan.
Mereka mengemukakan bahwa jumlah elektron terluar dari dua atom yang berikatan,
akan berubah sedemikian rupa sehingga susunan kedua elektron kedua atom
tersebut sama dengan susunan gas mulia. Kecenderungan atom-atom untuk memiliki
struktur atau konfigurasi elektron gas mulia atau 8 elektron pada kulit terluar
disebut kaidah oktet. Elektron
yang berperan dalam reaksi kimia yaitu elektron pada kulit
terluar atau elektron valensi. Elektron valensi menunjukan kemampuan suatu atom
untuk berikan dengan atom lain.[1]
Pendapat-pendapat
mereka, baik Kossel maupun Lewis, didasarkan pada konsep atom. Inti yang
bermuatan positif dikelilingi oleh sejumlah elektron yang beredar dalam
lintasan yang konsentris atau terdapat dalam tingkatann energi. Baik ikatan
ionik maupun kovalen terbentuk dengan adanya tendensi dari atom-atom yang
terikat untuk mencapai konfigurasi elektron gas mulia yang stabil.
Syarat
untuk memahami pembentukan molekul menurut teori ikatan valensi, kita harus
mengerti: (1) teori atom, (2) konfigurasi elektron, (3) elektron valensi. Perlu
diingat bahwa konfigurasi elektron suatu unsur dapat ditulis bila mengetahui unsur
yang terlibat dalam pembentukan ikatan dan nomor atom yang dimiliki.
Ikatan
ionik dibentuk dengan adanya transfer elektron dari satu atom ke atom lain.
Unsur-unsur yang terletak pada golongan I dan golongan II dalam sistem berkala
mempunyai sifat mudah melepaskan elektron. Unsur-unsur tersebut disebut
bersifat elektropositif. Unsur pada golongan VII yang disebut unsur halogen
bersifat mudah menerima atau menangkap elektron. Unsur-unsur halogen dikatakan
bersifat elektronegatif. Elektron yang dilepaskan dari unsur-unsur golongan I
dan golongan II merupakan elektron valensi. Elektron valensi memiliki tingkatan
tenaga yang paling besar, stabilitasnya rendah hingga mudah lepas dari
lintasan. Elektron yang dilepaskan tersebut kemudian akan ditangkap oleh unsur
golongan VII dan akan masuk pada orbital pz yang masih memiliki satu
elektron yang belum berpasangan.
2.
Teori
ikatan kimia sebelum abad ke-20
A.
Afinitas kimia
Teori
atom adalah premis untuk konsep ikatan kimia. Namun, teori afinitas lebih
disukai kimiawan abad 18 mungkin dapat dianggap sebagai asal teori ikatan kimia
modern, walaupun afinitas kimia merupakan teori reaksi kimia. Dasar teori
afinitas adalah konsep „like attract like“, sesama manarik sesama. Kimiawan
Perancis Étienne François Geoffroy (1672-1731) membuat tabel dengan enambelas
jenis zat didaftarkan dalam urutan afinitasnya pada zat lain Karya ini memiliki
signifikansi historis karena orang dapat memprediksi hasil reaksi dengan
bantuan Gambar dibawah.

Gambar tersebut menunjukkan Tabel
afinitas kimia dari Geoffroy. Simbol yang digunakan di tabel ini adalah simbol
yang awalnya digunakan para alkemi. Di baris pertama, enambelas zat
didaftrakan. Di bawah tiap zat in, zat lain dengan urutan afinitasnya pada zat
di baris pertama didaftarkan[2]
Sekitar
pertengahan abad 19, kimiawan mencari cara untuk mengukur afinitas kimia dengan
kuantititatif. Kimiawan Denmark Hans Peter Jargen Julius Thomsen (1826-1909)
dan kimiawan Pernacis Pierre Eugene Marcelin Berthelot (1827-1907) menggunakan
kalor yang dihasilkan dalam reaksi sebagai ukuran afinitas kimia. Namun, ada
beberapa reaksi yang endoterm, walaupun sebagian besar reaksi eksoterm.
Kemudian menjadi jelas, tidak ada hubungan yang sederhana antara kalor yang
dihasilkan dalam reaksi dan afinitas kimia.
B.
Dualisme Elektrokimia
Dualisme
elektrokimia adalah teori ikatan kimia rasional yang pertama, dan teori ini
diusulkan oleh Davy, Berzelius dkk di pertengahan pertama abad 19. Dasar teori
Berzelius adalah sebagai berikut:
Atom
berbagai unsur bermuatan positif atau negatif dalam jumlah yang berbeda, dan
muatan ini adalah gaya dorong pembentukan zat. Misalnya, tembaga bermuatan
listrik positif dan oksigen bermuatan negatif. Tembaga oksida terbentuk dengan
kombinasi kedua unsur tersebut masih sedikit positif. Hal ini yang menyebabkan
umumnya oksida logam yang agak positif dan air yang agak negatif bereaksi satu
sama lain menghasilkan hidroksida. Penemuan bahwa elektrolisis oksida logam
alkali menghasilkan logam dan oksigen dengan baik dijelaskan dengan dualisme
elektrokimia. Namun, ditemukan beberapa kasus yang tidak cocok dengan teori
ini. Menurut aksioma Berzelius, atom hidrogen bermuatan positif dan atom
khlorin bersifat negatif. Menurut teori Berzelius, walaupun asam asetat,
CH3COOH, bersifat asam, asam trikhloroasetat, CCl3COOH, seharusnya basa.
Berzelius percaya b ahwa muatan listrik adalah asal usul keasaman dan kebasaan.
Karena penukaran hidrogen dengan khlorin, yang muatannya berlawanan, akan
membentuk basa. Faktanya asam trikhloroasetat asam, bahkan lebih asam dari asam
asetat Dualisme elektrokimia dengan demikian perlahan ditinggalkan.
C.
Teori Valensi
Di
paruh akhir abad 19, teori yang lebih praktis diusulkan dari bidang kimia
organik. Banyak senyawa organik yang telah disintesis sebelum masa itu, dan
strukturnya telah ditentukan dengan analisis kimia. Karena dijumpai banyak
senyawa yang secara kimia mirip (misalnya, dalam nomenklatur saat ini
sifat-sifat deret asam karboksilat), kimiawan mengusulkan beberapa teori untuk
mengklasifikasikan dan mengurutkan kemiripan sifat ini. Menurut salah satu
teori, satu radikal (misalnya radikal benzoil, C7H5O–) yang terdiri dari
beberapa atom dianggap ekuivalen 4 3dengan satu atom dalam senyawa anorganik.
Teori lain menjelaskan bahwa kemampuan ikatan (afinitas kimia) atom tertentu
yang terikat sejumlah tertentu atom lain.
Beberapa
contoh senyawa dengan radikal benzoil

Kimiawan
Jerman Stradouity Friedrich August Kekulé (1829-1896) dan kimiawan Inggris
Archibald Scott Couper (1831-1892) mengelaborasikan teori kedua menjadi teori
valensi. Kekulé menganggap bahwa satu atom karbon memiliki empat satuan
afinitas (dalam terminologi modern, valensi) dan menggunakan satuan afinitas
ini dengan empat atom hidrogen membentuk CH4 atau berkombinasi dengan dua atom oksigen
membentuk CO2. [3]
Ia
juga menyarankan kemungkinan atom karbon dapat berkombinasi dengan atom karbon
lain, menggunakan satu dari empat valensinya, dan setiap atom karbon dapat
berkombinasi dengan atom lain termasuk atom karbon, dengan menggunakan tiga valensi
sisanya. Kekulé mengusulkan metoda menggambarkan molekul (yang disebut dengan
sosis Kekulé)
seperti gambar dibawah. Pada tahap
ini, valensi hanya sejenis indeks yang mengindikasikan rasio atom yang menyusun
molekul.

Gambar menunjukkan Struktur molekul
yang diusulkan oleh Kekulé. Pada tahap ini konsep ikatan kimia yang
menghubungkan atom belum jelas.
3.
Teori
ikatan kimia berdasarkan teori Bohr
A. Ikatan
ionic (Ionic bond)
To
determine the chemical bond with the deeper, the atom must be known with deeper.
From the early 20th century, scientists' understanding of atomic structure to
grow deep, and it is accelerating the development of the theory of chemical
bonding. Ionic bond is bond in which one or more electrons from one atom are
removed and attached to another atom, resulting in positive and negative ions
which attract each other.
Skin
K and L of sodium atoms fully charged electrons, but there is only one electron
in the outer shell (M). So sodium is easy to lose one's outer electrons into
the sodium ion Na + which has the same electron configuration with neon atoms
Ne (1s22s22p6). Chlorine atom electron configuration (1s22s22p63s23p5). When
one chlorine atom captures one electron untukmelengkapi M his skin in order to
become fully charged, the electron configuration becomes (1s22s22p63s23p6) that
is identical to the electron configuration of argon Ar.
At
that time, the sodium chloride crystal structures that have been analyzed by
X-ray crystallographic analysis, and the presence of sodium ions and chloride
have believed. Obviously there is no contradiction between theory and facts
Kossel all ionic compounds are described. However, this theory is not yet
complete, as in the case of electrochemical dualism, in which case this theory
fails to explain the fact ekesperimen like formation of compounds observed
hydrogen or C4 + cations or anions C4-.[4]
Translate/ Terjemahan dari Jurnal :
Untuk
mengetahui ikatan kimia dengan lebih dalam, atom harus dikenal dengan lebih
dalam. Dari awal abad 20, pemahaman ilmuwan tentang struktur atom bertambah
mendalam, dan hal ini mempercepat perkembangan teori ikatan kimia.
Ikatan
ion adalah di mana satu atau lebih elektron dari satu atom akan dihapus dan
melekat pada atom lain, sehingga ion positif dan negatif yang menarik satu sama
lain.
Kulit
K dan L atom natrium terisi penuh elektron, tetapi hanya ada satu elektron di
kulit terluar (M). Jadi natrium dengan mudah kehilangan satu elektron terluar
ini menjadi ion natrium Na+ yang memiliki konfigurasi elektron yang sama dengan
atom neon Ne (1s22s22p6). Konfigurasi elektron atom khlor (1s22s22p63s23p5).
Bila satu atom khlorin menangkap satu elektron untukmelengkapi kulit M-nya agar
menjadi terisi penuh, konfigurasi elektronnya menjadi (1s22s22p63s23p6) yang
identik dengan konfigurasi elektron argon Ar.
Pada waktu itu, sruktur kristal
natrium khlorida telah dianalisis dengan analisis kristalografik sinar-X, dan
keberadaan ion natrium dan khlorida telah diyakini. Jelas tidak ada
pertentangan antara teori Kossel dan fakta sepanjang senyawa ion yang
dijelaskan. Namun, teori ini belum lengkap, seperti dalam kasus dualisme
elektrokimia, dalam hal teori ini gagal menjelaskan fakta ekesperimen seperti
pembentukan senyawa hidrogen atau tidak diamatinya kation C4+ atau anion C4–.[5]
Contoh ikatan Ion :
Proses Pembentukan
Ikatan Ion Pada NaCl (Natrium Klorida)
Perhatikan konfigurasi
elektron atom natrium dan atom klor dibawah ini :
11 Na 1s2 2s2 2p6 3s1
atau 2 8 1
17 Cl 1s2 2s2 2p6 3s2
3p5 atau 2 8 7
Atom
natrium cenderung melepaskan satu elektron, agar kulit terluarnya mengandung
delapan elektron. Dan atom klor cenderung menangkap satu elektron agar memiliki
delapan elektron dikulit terluar. Jika atom Na bertemu dengan atom Cl, maka
atom Na memberikan elektron kepada atom Cl.
Akibatnya terbentuklah ikatan ion
Na + dan Ion Cl - :
Na ———> Na+ + e (melepaskan satu
elektron)
Cl + e ———> Cl¯ (menerima satu
elektron)

Antara
ion Na+ dan ion Cl¯ terjadi tarik menarik karena muatan mereka berlawanan.
Akibatnya terbentuklah senyawa NaCl. Terbentuknya ikatan ion Na+ dan Cl¯
membentuk senyawa NaCl (garam). Penggambaran ikatan ion natrium dan klorida
membentuk senyawa natrium klorida (NaCl) dapat dianalogikan sebagai gambar
perempuan dan laki-laki sebagai berikut.[6]
B. Ikatan
kovalen
Sekitar
tahun 1916, dua kimiawan Amerika, Gilbert Newton Lewis (1875-1946) dan Irving
Langmuir (1881-1957), secara independen menjelaskan apa yang tidak terjelaskan
oleh teori teori Kossel dengan memperluasnya untuk molekul non polar. Titik
krusial teori mereka adalah penggunaan bersama elektron oleh dua atom sebagai
cara untuk mendapatkan kulit terluar yang diisi penuh elektron. Penggunaan
bersama pasangan elektron oleh dua atom atau ikatan kovalen adalah konsep baru
waktu itu. Teori ini kemudian diperluas menjadi teori oktet. Teori ini
menjelaskan, untuk gas mulia (selain He), delapan elektron dalam kulit
valensinya disusun seolah mengisi kedelapan pojok kubus sementara untuk atom
lain, beberapa sudutnya tidak diisi elektron.
Pembentukan
ikatan kimia dengan penggunaan bersama pasangan elektron dilakukan dengan
penggunaan bersama rusuk atau bidang kubus. Dengan cara ini dimungkinkan untuk
memahami ikatan kimia yang membentuk molekul hidrogen. Namun, pertanyaan paling
fundamental, mengapa dua atom hidrogen bergabung, masih belum terjelaskan.
Sifat sebenarnya ikatan kimia masih belum terjawab.

Teori oktet Lewis/Langmuir. Model
atom dan molekul sederhana. Ikatan tunggal diwakili oleh penggunaan rusuk
kubus, ikatan ganda dengan penggunaan bersama bidang kubus.
Lewis mengembangkan simbol untuk
ikatan elektronik untuk membentuk molekul (struktur Lewis atau rumus Lewis)
dengan cara sebagai berikut. Aturan penulisan rumus Lewis
1) Semua elektron valensi
ditunjukkan dengan titik di sekitar atomnya.
2) Satu ikatan (dalam hal ini,
ikatan tunggal) antara dua atom dibentuk dengan penggunaan bersama dua elektron
(satu elektron dari masing-masing atom)
3) Satu garis sebagai ganti
pasangan titik sering digunakan untuk menunjukkan pasangan electron ikatan.
4) Elektron yang tidak digunakan
untuk ikatan tetap sebagai elektron bebas. Titik-titik tetap
digunakan untuk menyimbolkan
pasangan elektron bebas.
5) Kecuali untuk atom hidrogen
(yang akan memiliki dua elektron bila berikatan), atom umumnya akan memiliki
delapan elektron untuk memenuhi aturan oktet.
Berikut adalah contoh-contoh
bagaimana cara menuliskan struktur Lewis.[7]

Untuk
menggambarkan bagaimana ikatan kovalen terjadi, digunakan rumus titik elektron
(struktur Lewis). Rumus ini dapat menggambarkan peranan elektron valensi dalam
mengadakan ikatan. Rumus Lewis merupakan tanda atom yang di sekelilingnya
terdapat titik, silang atau bulatan kecil yang menggambarkan elektron valensi
atom yang bersangkutan.
Contoh:

Bila
dua atom hidrogen membentuk ikatan, maka masing-masing atom akan menyumbangkan
sebuah elektron dan membentuk sepasang elektron yang digunakan bersama. Dengan
membentuk pasangan elektron maka masing-masing atom akan mempunyai konfigurasi
yang sama dengan atom helium dengan dua elektron pada kulit terluarnya. Sepasang
elektron dapat digantikan dengan sebuah garis yang disebut tangan ikatan,
sehingga pada molekul H2 dapat digambarkan sebagai berikut.

Jumlah
tangan ikatan dapat menggambarkan jumlah ikatan dalam suatu senyawa kovalen,
dalam molekul H2 di atas ikatannya disebut ikatan kovalen tunggal. Molekul O2
terjadi dari dua atom oksigen dengan ikatan kovalen rangkap, sedangkan ikatan
pada molekul N2 terjadi tiga ikatan kovalen yang disebut dengan ikatan rangkap
tiga.
Dalam
pembentukan ikatan kovalen belum tentu semua elektron valensi digunakan untuk
membentuk pasangan elektron bersama. Pasangan elektron yang digunakan bersama
oleh dua atom yang berkaitan disebut pasangan
elektron ikatan (PEI), sedangkan pasangan elektron yang tidak digunakan
bersama oleh kedua atom pasangan
elektron bebas (PEB).
Penggambaran
rumus titik elektron (struktur Lewis) dari molekul beratom banyak (poliatom)
kadang-kadang menimbulkan kesulitan. Untuk mengatasi hal tersebut perlu dibuat
beberapa kemungkinan. Beberapa catatan berikut dapat berguna dalam meramalkan
struktur Lewis dari molekul yang beratom banyak. Semua elektron terluar
(elektron valensi) dari masing-masing atom yang berikatan harus
dihitung.Umumnya atom-atom dalam struktur Lewis akan mempunyai delapan valensi,
kecuali atom hidrogen yang hanya akan mempunyai 2 elektron (duplet).
Jumlah
elektron yang diterima oleh suatu atom akan sama dengan yang diberikan, kecuali
terjadi ikatan koordinasi, yaitu suatu atom hanya memberi atau menerima saja
pasangan elektron. Umumnya dalam struktur Lewis semua elektron berpasangan,
termasuk pasangan elektron bebas (tidak untuk berikatan).[8]
C. Ikatan
koordinat
Dengan
menggabungkan teori valensi dengan teori ikatan ion dan kovalen, hampir semua
ikatan kimia yang diketahui di awal abad 20 dapat dipahami. Namun, menjelasng
akhir abad 19, beberapa senyawa yang telah dilaporkan tidak dapat dijelaskan
dengan teori Kekulé dan Couper. Bila teori Kekulé dan Couper digunakan untuk
mengintepretasikan struktur garam luteo, senyawa yang mengandung kation logam
dan aminua dengan rumus rasional Co(NH3)6Cl3, maka struktur singular (gambar
3.4(a)) harus diberikan. Struktur semacam ini tidak dapat diterima bagi
kimiawan Swiss Alfred Werner (1866-1919).
Ia
mengusulkan bahwa beberapa unsur termasuk kobal memiliki valensi tambahan,
selain valensi yang didefinisikan oleh Kekulé dan Couper, yang oleh Werner
disebut dengan valensi utama. Menuru Werner, atom kobalt dalam garam luteo
berkombinasi dengan tiga anion khlorida dengan valensi utamanya (trivalen) dan
enam amonia dengan valensi tambahannya (heksavalen) membentuk suatu oktahedron
dengan atom kobaltnya di pusat.

Setelah
melalui debat panjang, kebenaran teori Werner diterima umum, dan ditemukan
bahwa banyak senyawa lain yang memiliki valensi tambahan. Dalam senyawa-senyawa
ini, atomnya (atau ionnya) yang memerankan peranan kobalt disebut dengan atom
pusat, dan molekul yang memerankan seperti amonia disebut dengan ligan. Sifat
sebenarnya dari valensi tambahan ini diungkapkan oleh kimiawan Inggris Nevil
Vincent Sidgewick (1873-1952). Ia mengusulkan sejenis ikatan kovalen dengan
pasangan elektron yang hanya disediakan oleh salah satu atom, yakni ikatan
koordinat.. Jadi atom yang menerima pasangan elektron harus memiliki orbital kosong
yang dapat mengakomodasi pasangan elektron. Kekulé telah mengungkapkan amonium
khlorida sebagai NH3・HCl.
Menurut Sidgewick, suatu ikatan koordiant dibentuk oleh atom nitrogen dari
amonia dan proton menghasilkan ion ammonium NH4+, yang selanjutnya membentuk
ikatan ion dengan ion khlorida menghasilkan ammonium khlorida.

Amonia
adalah donor elektron karena mendonorkan pasangan elektron, sementara proton
adalah akseptor elektron karena menerima pasangan elektron di dalam orbital
kosongnya.
Penyimpangan
Kaidah Oktet
Beberapa molekul kovalen mempunyai
struktur Lewis yang tidak oktet atau duplet. Struktur demikian dapat dibenarkan
karena fakta menunjukkan adanya senaywa tersebut, misalnya CO dan BF3.
Ditemukan beberapa senyawa kovalen yang tidak sesuai dengan aturan oktet,
tetapi dapat terbentuk dan cukup stabil. Hal ini disebut, pengecualian aturan
oktet yaitu sebagai berikut.
1. Oktet yang tidak sempurna, yaitu
senyawa yang mempunyai atom dengan elektron valensi kurang dari delapan
Contohnya: Be dalam BeCl2.
2. Oktet yang diperluas, yaitu
senyawa yang mempunyai atom dengan elektron valensi lebih dari delapan.
Contohnya: P dalam PCl5.
3. Elektron tidak berpasangan
(spesi ganjil) yaitu senyawa yang mempunyai atom dengan elektron valensi tidak
berpasangan. Contohnya: N dalam NO2.[9]
4.
Teori
Kuantum Ikatan Kimia
A. Metoda
Heitler dan London
Sebagaimana
dipaparkan di teori Bohr, walaupun merupakan model revolusioner, namun gagal
menjelaskna mengapa atom membentuk ikatan. Teori Lewis-Langmuir tentang ikatan
kovalen sebenarnya kualitatif, dan gagal memberikan jawaban pada pertanyaan
fundamental mengapa atom membentuk ikatan, atau mengapa molekul lebih stabil
daripada dua atom yang membentuknya.
Masalah
ini diselesaikan dengan menggunakan mekanika kuantum (mekanika gelombang).
Segera setelah mekanika kuantum dikenalkan, fisikawan Jerman Walter Heitler
(1904-1981) dan fisikawan Jerman/Amerika Fritz London (1900-1954) berhasil
menjelaskan pembentukan molekul hydrogen dengan penyelesaian persamaan
gelombang sistem yang terdiri atas dua atom hidrogen dengan pendekatan.
Sistemnya adalah dua proton dan dua elektron Mereka menghitung energi sistem
sebagai fungsi jarak antar atom dan mendapatkan bahwa ada lembah dalam yang
berkaitan dengan energi minimum yang diamati dalam percobaan (yakni pada jarak
ikatan) tidak dihasilkan. Mereka mengambil pendekatan lain: mereka menganggap
sistem dengan elektron yang posisinya dipertukarkan dan menghitung ulang dengan
asumsi bahwa dua system harus menyumbang sama pada pembentukan ikatan. Mereka
mendapatkan kemungkinan pembentukan ikatan meningkat, dan hasil yang sama
dengan hasil percobaan diperoleh.

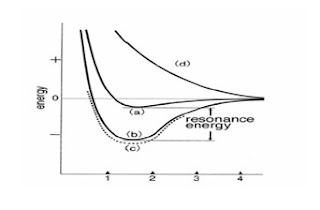
Keadaan sistem yang terdiri atas
dua atom hidrogen. Lokasi elektron dipertukarkan antara (a) dan (b). Sistemnya
beresonansi antara keadaan (a) dan (b).
Dua
keadaan di gambar disebut “beresonansi”. Perbedaan energi antara plot (a) dan
(b) disebut energi resonansi. Enerhi di gambar 3.6(d) adalah energi untuk
keadaan dengan spin dua elektronnya sejajar. Dalam keadaan ini, tolakannya
dominan, yang akan mendestabilkan ikatan, yakni keadaan antibonding. Metoda
Heitler dan London adalah yang pertama berhasil menjelaskan dengan kuantitatif
ikatan kovalen.[10]

B. Pendekatan
ikatan valensi
Marilah
kita perhatikan metoda Heitler dan London dengan detail. Bila dua atom hidrogen
dalam keadaan dasar pada jarak tak hingga satu sama lain, fungsi gelombang
sistemnya adalah 1s1(1)1s2(2) (yang berkaitan dengan keadaan dengan elektron 1
berkaitan dengan proton 1 dan elektron 2 berhubungan dengan proton 2
sebagaimana diperlihtakna di gambar 3.5(a) (atau 1s1(2)1s2(1) yang berkaitan
dengan keadaan dimana elektron 2 terikat di proton 1 dan elektron 1 berikatan
dengan proton 2 sebagaimana diperlihatkan gambar 3.5(b)). Bila dua proton
mendekat, menjadi sukar untuk membedakan dua proton. Dalam kasus ini, sistemnya
dapat didekati dengan mudah kombinasi linear dua fungsi gelombang. Jadi,

dengan
N+ dan N- adalah konstanta yang menormalisasi fungsi gelombangnya 9 . Dengan
menyelesaikan persamaan ini, akan diperoleh nilai eigen E+ dan E- yang
berkaitan dengan gambar. Metoda yang dipaparkan di atas disebut dengan metoda
ikatan valensi (valence-bond/VB). Premis metoda VB adalah molekul dapat
diungkapkan dengan fungsi-fungsi gelombang atom yang menyusun molekul. Bila dua
elektron digunakan bersama oleh dua inti atom, dan spin kedua elektronnya
antiparalel, ikatan yang stabil akan terbentuk.
C. Pendekatan
orbital molekul
Metoda VB dikembangkan lebih lanjut
oleh ilmuwan Amerika termasuk John Clarke Slater (1900-1978) dan Linus Carl
Pauling (1901-1994). Namun, kini metoda orbital molekul (molecular orbital, MO)
jauh lebih populer. Konsep dasar metoda MO dapat dijelaskan dengan mudah dengan
mempelajari molekul tersederhana, ion molekul H2+
5.
Jenis
ikatan kimia lain
A. Ikatan
logam
Setelah
penemuan elektron, daya hantar logam yang tinggi dijelaskan dengan menggunakan
model elektron bebas, yakni ide bahwa logam kaya akan elektron yang bebas
bergerak dalam logam. Namun, hal ini tidak lebih dari model. Dengan kemajuan
mekanika kuantum, sekitar tahun 1930, teori MO yang mirip dengan yang digunakan
dalam molekul hidrogen digunakan untuk masalah kristal logam. Elektron dalam
kristal logam dimiliki oleh orbital-orbital dengan nilai energi diskontinyu,
dan situasinya mirip dengan elektron yang mengelilingi inti atom.
Namun,
dengan meingkatnya jumlah orbital atom yang berinteraksi banyak, celah energi
dari teori MO menjadi lebih sempit, dan akhirnya perbedaan antar
tingkat-tingkat energi menjadi dapat diabaikan. Akibatnya banyak tingkat energi
akan bergabung membentuk pita energi dengan lebar tertentu. Teori ini disebut
dengan teori pita.
Tingkat
energi logam magnesium merupakan contoh teori pita yang baik. Elektron yang ada
di orbital 1s, 2s dan 2p berada di dekat inti, dan akibatnya terlokalisasi di
orbital-orbital tersebut. Hal ini ditunjukkan di bagian bawah. Namun, orbital
3s dan 3p bertumpang tindih dan bercampur satu dengan yang lain membentuk MO.
MO ini diisi elektron sebagian, sehingga elektron-elektron ini secara terus
menerus dipercepat oleh medan listrik menghasilkan arus listrik. Dengan
demikian, magnesium adalah konduktor.

Representasi skematik MO logam
magnesium. Orbital 1s, 2s dan 2p terlokalisasi, tetapi orbital 3s dan 3p
bertumpangtindih membentuk struktur pita
B. Ikatan
hidrogen
Awalnya diduga bahwa alasan mengapa
hidrogen fluorida HF memiliki titik didih dan titik leleh yang lebih tinggi
dibandingkan hidrogen halida lain (gambar 3.9) adalah bahwa HF ada dalam bentuk
polimer. Alasan tepatnya tidak begitu jelas untuk kurun waktu yang panjang. Di
awal tahun 1920-an, dengan jelas diperlihatkan bahwa polimer terbentuk antara
dua atom flourin yang mengapit atom hidrogen. Sangat tingginya titik didih dan
titik leleh air juga merupakan masalah yang sangat menarik. Diawal tahun
1930-an, ditunjukkan bahwa dua atom oksigen membentk ikatan yang mengapit
hidrogen seperti dalam kasus HF Kemudian diketahui bahwa ikatan jenis ini
umumdidapatkan dan disebut dengan ikatan hidrogen.[12]

Titik didih senyawa-senyawa
hidrogen. Terlihat bahwa titik didih senyawa yang terbentuk oleh unsur periode
kedua (N, O, F) menyimpang dari senyawa unsur segolongannya.
Ikatan
hidrogen dengan mudah terbentuk bila atom hidroegen terikat pada atom
elektronegatif seperti oksigen atau nitrogen. Fakta bahwa beberapa senyawa organik
dengan gugus hidroksi – OH atau gugus amino –NH2 relatif lebih larut dalam air
disebabkan karena pembentukan ikatan hidrogen dengan molekul air. Dimerisasi
asam karboksilat seperti asama asetat CH3COOH juga merupakan contoh yang sangat
baik adanya ikatan hidrogen.

C. Ikatan
Van der Waals
Gaya
dorong pembentukan ikatan hidrogen adalah distribusi muatan yang tak seragam
dalam molekul, atau polaritas molekul (dipol permanen). Polaritas molekul
adalah sebab agregasi molekul menjadi cair atau padat. Namun, molekul non polar
semacam metana CH4, hidrogen H2 atau He.(molekul monoatomik) dapat juga
dicairkan, dan pada suhu yang sangat rendah, mungkin juga dipadatkan. Hal ini
berarti bahwa ada gaya agreagasi antar molekul-molekul ini.. Gaya semacam ini
disebut dengan gaya antarmolekul. Ikatan hidrogen yang didiskusikan di atas
adalah salah satu jenis gaya antarmolekul.
Gaya
antarmolekul khas untuk molekul non polar adalah gaya van der Waals. Asal usul
gaya ini adalah distribusi muatan yang sesaat tidak seragam (dipol sesaat) yang
disebabkan oleh fluktuasi awan elektron di sekitar inti. Dalam kondisi yang
sama, semakin banyak jumlah elektron dalam molekul semakin mudah molekul
tersebut akan dipolarisasi sebab elektron-elektronnya akan tersebar luas. Bila
dua awan elektron mendekati satu sama lain, dipol akan terinduksi ketika awan
electron mempolarisasi sedemikian sehingga menstabilkan yang bermuatan
berlawanan. Dengan gaya van der Waals suatu sistem akan terstabilkan sebesar 1
kkal mol–1. Bandingkan harga ini dengan nilai stabilisasi yang dicapai dengan
pembentukan ikatan kimia (dalam orde 100 kkal mol–1). Kimiawan kini sangat
tertarik dengan supramolekul yang terbentuk dengan agregasi molekul dengan gaya
antarmolekul.[13]
2.2 Teori Ikatan
Valensi
Teori ikatan valensi mula-mula
dikemukakan oleh Heitler dan Slater, dan kemudian dikembangkan oleh Pauling dan
Coulson, Teori ini bertolak dari fakta bahwa atom sebelum berikatan terpisah
satu sama lain. Setelah berikatan, terjadi tumpang tindih orbital kulit terluarnya,
sehingga elektron didalamnya menjadi milik berdua. Yang bertindihan hanya
orbital yang mengandung elektron yang tidak berpasangan dan setelah bergabung
menjadi berpasangan, contohnya H2.
Dua
elektron dapat bergabung dalam satu orbital bila spinnya berlawanan. Satu
elektron yang tidak berpasangan pada orbital terluar suatu atom akan tarik
menarik dengan elektron terluar atom lain. Akibatnya, kedua atom terikat karena
adanya pasangan elektron tersebut.
Dua atom yang berjauhan tidak punya
daya tarik menarik atau daya tarik menariknya kecil sekali. Jika keduanya makin
mendekat, daya tarik bertambah sehingga terjadi tumpang tindih orbital. Tumpang
tindih tidak bisa terlalu besar karena ada gaya tolak menolak muatan positif
kedua inti. Jadi, terdapat hubungan antara energi potensial (daya tarik dan
daya tolak atom) dengan jarak kedua atom. Jarak yang stabil suatu ikatan
disebut jari-jari kovalen. Pada jarak ini, perbedaan daya tarik kedua atom
dengan daya kedua inti bernilai maksimum.
Kekuatan ikatan bergantung pada
besarnya pertindihan orbital. Berdasarkan itu dikenal dua macam ikatan , yaitu
ikatan σ (sigma) dan ikatan π (pi). Ikatan σ mempunyai pertindihan lebih besar
maka ikatannya lebih kuat, sedangkan ikatan π lebih lemah karena pertindihannya
kecil. Yang termasuk ikatan σ adalah ikatan s-s, s-p, dan p-p yang segaris,
sedangkan ikatan p-p yang sejajar. [14]
Linus Pauling (1931) mengembangkan
ikatan valensi modern untuk senyawa koordinasi, yang kemudian dikenal sebagai
VBT, dengan mengenalkan konsep hibridisasi. Beberapa contoh konfigurasi
elektron ion pusat dalam senyawa kompleks pada orbital d dan orbital hibrida yang bersangkutan diuraikan seperti berikut :
Zink
(II) selain membentuk garam normal ZnCl2 dapat pula membentuk ion
kompleks [ZnCl4]2-. Menurut konsep hibridisasi , dalam
kedua senyawa tersebut masing-masing Zn(II) mengalami hibridisasi sp dan sp3. Pada ion kompleks [ZnCl4]2- ,
keempat pasang electron dari 4 atom donor ligan klorido menempati keempat
orbital hibrida sp3 dalam
bangun tetrahedron. Ion kompleks [ZnCl4]2- bersifat diamagnetik,dan sifat ini sesuai dengan
konfigurasi elektronik .
Contoh diatas menunjukkan bahwa
teori ikatan valensi dengan konsep hibridisasi, cukup baik untuk menjelaskan
bentuk geometri molekul maupun sifat magnetic senya wa kompleks. Lagi pula
konsep hibridisasi ini dapat menunjukkan adanya dua kemungkinan konfigurasi
electron dx dengan spin terpasang (spin paired) sehingga
menghasilkan kompleks spin rendah
(low-spin, ls).
Klasifikasi Pauling tersebut jelas
sembarangan dan “menyesatkan” karena istilah ionic dan kovalen (molekular)
seharusnya dikaitkan dengan sifat elektrolit/nonelektrolit, bukan pada sifat spin rendah/spin tinggi.[15]
Teori
ikatan valensi dapat digunakan untuk menerangkan pembentukan ikatan ionik
(ikatan elektrovalen).
Konfigurasi
elektron unsur Li:
Li3:
1s2 2s1 → 1e- + 1s2 ; Li+
Li
memiliki elektron valensi satu yang terletak pada orbital 2s. Li bersifat
elektropositif dan dapat melepaskan elektron valensinya. Setelah Li melepaskan
elektron valensinya, maka Li yang semula bersifat netral akan berubah menjadi
ion yang bemuatan positif. Sekarang ion Li+ memiliki konfigurasi elektron gas
mulia He, yang disebut memiliki sistem dublet.
2.3 Teori Kovalen
Walaupun
konsep molekul telah diperkenalkan sejak abad ke-17, tetapi bagaimana dan
mengapa molekul terbentuk baru bisa dimengerti para kimiawan pada awal abad
ke-20. Terobosan besar yang datang dari Gilbert Lewis yang mengajukan bahwa
ikatan kimia melibatkan penggunaan elektron secara bersama-sama oleh atom-atom
yang berikatan.
Senyawa
kovalen (covalent compound) adalah senyawa yang hanya bisa mengandung ikatan
kovalen. Secara sederhana, pasangan elektron yang digunakan bersama sering
dinyatakan dengan satu garis. Jadi, ikatan kovalen dalam molekul hidrogen dapat ditulis sebagai
H-H. Pada ikatan kovalen, setiap elektron dalam pasangan elektron ikatan yang
digunakan ditarik oleh inti dari kedua atom yang berkaitan. Gaya tarikan elektron
ke inti inilah yang mengikat kedua atom hidrogen dalam molekul H2
dan yang berperan dalam pembentukan ikatan kovalen dalam molekul yang lainnya.
Struktur yang digunakan untuk menggambarkan senyawa kovalen seperti H2
disebut struktur lewis. Struktur Lewis (Lewis structure) adalah penggambaran
ikatan kovalen yang menggunakan lambang titik Lewis dimana pasangan elektron
ikatan dinyatakan dengan satu garis atau sepanjang titik yang diletakkan di
antara kedua atom, dan pasangan elektron bebas dinyatakan dengan titik-titik
pada masing-masing atom. Hanya elektron valensi yang ditunjukkan pada struktur
Lewis.
Pembentukan
dari molekul-molekul mengilustrasikan aturan oktet (octet rule) yang dirumuskan
oleh Lewis: sebuah atom, kecuali atom
hidrogen, cenderung membentuk ikatan sampai atom itu dikelilingi oleh delapan
elektron valensi. Dengan kata lain, ikatan kovalen terbentuk jika elektron
yang tersedia tidak tidak cukup untuk masing-masing atom mencapai oktet yang
lengkap. Masing-masing atom dapat melengkapi oktetnya dengan menggunakan
elektron secara bersama dalam ikatan kovalen. Persyaratan untuk atom hidrogen
adalah untuk mencapai konfigurasi elektron helium, yaitu dikelilingi oleh dua
elektron.
Aturan
oktet berlaku terutama untuk unsur-unsur dalam periode kedua pada tabel
periodik. Unsur-unsur ini hanya memiliki orbital subkulit 2s dan 2p yang dapat
menampung maksimum delapan elektron. Pada pembentukan senyawa kovalen senyawa
kovalen, atom dari periode kedua ini dapat mencapai konfigurasi elektron gas
mulia [Ne] melalui penggunaan elektron bersama dengan atom lain dalam senyawa
yang sama. Ada beberapa pengecualian penting dari aturan oktet yang memberikan
pengertian lebih dalam tentang sifat ikatan kimia.
Atom-atom
dapat membentuk berbagai jenis ikatan kovalen yang berbeda. Dua atom yang berikatan melalui sepasang elektron disebut ikatan tunggal.
Dalam beberapa senyawa, atom-atom berikatan dengan ikatan rangkap, yaitu ikatan
yang terbentuk jika dua atom menggunakan dua atau lebih pasangan elektron
secara bersama-sama. Ikatan antara dua atom yang menggunakan bersama dua
pasang elektron, disebut ikatan rangkap
dua. Jika dua atom menggunakan bersama tiga pasang elektron maka disebut ikatan
rangkap tiga.[16]
Ikatan kovalen dihasilkan berdasarkan penggunaan bersama elektron valensi dari
atom-atom yang mengadakan ikatan, seperti contoh dalam pembentukan molekul
hidrogen. Setiap atom hidrogen memiliki satu elektron valensi dengan penggunaan
bersama elektron valensi maka kedua kedua atom hidrogen membentuk molekul
hidrogen. Sekarang atom hidrogen dikelilingi dua elektron seperti konfigurasi
elektron gas mulia helium.
Berdasarkan
konvensi simbol/tanda elektron dinyatakan dengan titik (.),
sedangkan ikatan yang merupakan pasangan elektron diberi tanda dengan garis
pendek (-). Beberapa contoh molekul atau senyawa berikut terbentuk dengan
ikatan kovalen.[17]
2.4 Hibridisasi
Hibdrisasi
adalah sebuah konsep bersatunya orbital orbital atom membentuk orbital hibrid
yang baru yang sesuai dengan penjelasan kualitatif sifat ikatan atom. Konsep
orbital orbital yang terhibridisasi sangatlah berguna dalam menjelaskan bentuk
orbital molekul dari sebuah molekul.
HIBRIDISASI
DAN BENTUK MOLEKUL
Teori
VSEPR sangat bermanfaat untuk meramalkan struktur molekul suatu senyawa, tetapi
teori tersebut tidak menjelaskan tentang bagaimana elektron-elektron dalam
kulit valensi atom pusat dapat membentuk struktur tertentu. Untuk mengetahui
hal ini dapat dijelaskan dengan hibridisasi orbital atom sebagai implementasi
dari teori ikatan valensi.
1.
Hibridisasi dan Model
Ikatan Valensi Terarah
Menurut
teori ikatan valensi, ikatan akan terbentuk antara dua atom jika memenuhi
syarat-syarat sebagai berikut:
a. Dalam
membentuk ikatan, orbital-orbital pada atom pusat mengadakan restrukturisasi
melalui proses hibridisasi membentuk orbital hibrida. Selanjutnya orbital hibrida ini berikatan dg orbital atom
lain.
b. Orbital-orbital
yang berikatan harus bertumpangsuh (overlapping)
satu sama lain.
c. Jumlah
elektron dalam orbital ikatan yang bertumpangsuh maksimal dua elektron dengan
spin berlawanan.
d. Kekuatan
ikatan bergantung pada derajat tumpangsuh. Makin besar daerah tumpangsuh makin
kuat ikatan yang terbentuk.
e. Orbital-orbital
atom selain orbitals dalam berikatan memiliki arah tertentu sesuai orientasi
orbital atom yang diberikan.
a. Hibridisasi
Orbital Atom
Hibridisasi
adalah proses pengacukan (pencampuran) orbital-orbital atom membentuk orbital
baru dengan tingkat energi berada diantara orbital-orbital yang dicampurkan.
Hasil pencampuran orbital dinamakan orbital hibrida. Ketika atom hidrogen
mendekati atom karbon, terjadi perubahan tingkat energi orbital-orbital pada
atom karbon sedemikian rupa sehingga dikemungkinan terjadinya hibridisasi
orbital-orbital valensi atom karbon.
Oleh
karena itu orbital hibrida yang dibentuk memiliki tingkat energi yang sama (di
antara 2s dan 2p), maka elektron yang berasal dari
orbital 2s dipromosikan ke
orbital sp3 yang masih kosong.
Oleh
karena orbital hibrida yang terbentuk berasal dari satu orbital s dan tiga
orbital p, maka orbital hibrida disebut orbital
sp3.
Dalam
proses hibridisasi, berlaku hukum kekekalan orbital. Artinya jumlah orbital
sebelum ddan sesudah dicampurkan sama. Jadi hibridisasi satu orbital s dan tiga
orbital p akan terbentuk empat orbital sp3.
b. Bentuk
Molekul dan Ikatan Valensi Terarah
Menurut
teori ikatan valensi, pada pembentukan ikatan, orbital-orbital hibrida dari
atom pusat harus bertumpangsuh dengan orbital atom lain dengan arah tertentu.
Pada molekul CH4 orbital hibrida sp3 dari atom karbon
akan bertumpangsuh dengan orbital s dari atom hidrogen membentuk ikatan
terlokalisasi sp3-s sepanjang sumbu ikatan C-H. Oleh karena ikatan
yang terbentuk memiliki orientasi tertentu dalam ruang, maka ikatan ini disebut
ikatan valensi terarah.
Jenis
orbital hibrida yang dapat dibentuk dari kombinasi orbital s, p, d adalah
orbital hibrida sp, sp2, sp3, dsp3, sp3d2,
atau d2sp3. Orbital-orbital tersebut memiliki orientasi
tertentu dalam ruang.
a) Struktur
linear
Molekul BeH2
menurut prediksi teori domain elektron adalah linear. Jika dilihat dari
konfigurasi elektronnya, atom Be tidak memiliki elektron yang tidak
berpasangan. Jadi tidak mungkin dapat berikatan membentuk molekul, tetapi
faktanya atom Be dapat membentuk molekul BeH2.
Agar atom Be dapat
berikatan dengan atom H, maka orbital-orbital 2s pada kulit valensi mengadakan
hibridisasi dengan orbital 2p yang masih kosong, diikuti promosi elektron dari
orbital 2s ke orbital 2p.
Orbital hibrida sp
memiliki dua aspek penting, yaitu:
a)
Setiap orbital
menyediakan daerah tumpangsuh yang cukup besar dengan orbital 1s dari atom
hidrogen.
b)
Orbital-orbital
tersebut memiliki orientasi 180o satu sama lain.
Dua orbital 2p yang
tidak digunakan membentuk orbital hibrida berada pada posisi tegak lurus satu
sama lain terhadap sumbu yang dibentuk oleh orbital hibrida sp.
b) Struktur
Segitiga Datar
c) Struktur
Tetrahedral
d) Struktur
Dwilimas dan Oktahedral
2.
Hibridisasi dalam
molekul yang memiliki pasangan elektron bebas[18]
Pengaruh
hibridisasi orbital terhadap keasamaan
Perbedaan
yang sangat menarik dari sifat keasaman alkuna alkena dan alkana adalah alkuna
lebih asam dari elkena dan alkena lebih asam dari alkana. Bila alkuna
direaksikan dengan basa kuat seperti natrium amida(NaNH2). Maka
hidrogen terminal alkuna akan bereaksi menjadi amonia dan terbentuk ion
asetilida. Hal ini tidak terjadi pada alkena dan alkana.
Mengapa
hidrogen terminal alkuna lebih bersifat asam daripada hidrogen terminal alkena
dan alkana atau kata lain mengapa anion asetilida lebih stabil daripada anion
vinil atau anion alkil. Karena adanya hibridisasi muatan negatif atom karbon.
Anion asetilida mempunyai hibridisasi sp. Sehingga muatan negatif berada pada
orbital yang mempunyai ½ karakter s.
Anion vinilik mempunyai hibridisasi sp2 bahwa orbital yang mempunyai ⅓ karekter s dan
anion alkil mempunyai ¼ karekter s. Telah diketahui bahwa orbital s mempunyai
energi yang rendah dan lebih dekat ke inti positif daripada orbital p. Muatan
negatif akan distabilkan oleh orbital s daripada oleh orbital dengan karakter s
yang rendah orbital p.
Orbital
hibrid
Elektron
elektron pada orbital 2s lebih stabil daripada elektron elktron orbital 2p.
Orbital tipe s terpusat pada inti yang meningkatkan interaksi antara inti
bermuatan positif dan elektron elektron orbital. Orbital tipe p diproyeksikan
jauh dari inti sehingga elektron otbital ini kurang dapat distabilkan oleh
muatan positif.[19]
Bentuk
dan arah suatu otbital hibrid merefleksikan gabungan dari orbital orbital
atomik konsekuensi dari keelektronegatifan orbital hibrid adalah orbital hibrid
akan dipengaruhi oleh inti lebih bersifat s Jika makin elektronegatif. Demikian
halnya hidrogen yang apabila semakin bersifat elektropositif semakin besar
keasamaannya.
Efek
induktif
Alkana
merupakan senyawa nonpolar sebab ikatan C C pada senyawa ini tidak mempunyai
netto momen dipol muatan. Jika pada alkana terdapat gugus atom yang
elektronegatif maka elektron ikatan sigma akan tertarik terpolarisasi kearah
gugus elektronegatif. Peristiwa ini disebut efek induktif.
Polarisasi
muatan melalui ikatan sigma yang mengakibatkan perbedaan keelektronegatifan ini
disebut efek induktif.[20]
1. ORBITAL
HIBRIDA KARBON
Atom
karbon memiliki dua orbital 2s dan 2p untuk membentuk ikatan. Terdapat dua
elektron tak berpasangan satu dalam tiap orbital 2p artinya atom karbon hanya
dapat membentuk dua ikatan dengan hidrogen dalam keadaan dasar. Walaupun spesi
CH2 memang dikenal spesi ini
sangat tidak stabil. Fakta menunjukkan bahwa atom karbon membentuk ikatan C H
dan menghasilkan CH4 dengan bentuk bangun ruang tetrahedron.
Hibridisasi
adalah pencampuran dua atau lebih orbital atom membentuk jumlah orbital hibrida
yang sama. Dimana masing masing orbital mempunyai bentuk dan energi yang sama.[21]
1.1 Hibridisasi
sp3
Atom
karbon memiliki konfigurasi ground state pada kulit terluar terdapat dua
elektron dalam orbital 2s dan dua elektron tak berpasangan dalam orbital 2p.
1.2
Hibridisasi sp2
Hibridisasi
sp2 digunakan bila karbon membentuk ikatan rangkap dua. Untuk
membentuk orbital ikatan sp2 karbon menghibridisasiorbital 2enya
hanya dengan dua orbital 2pnya. Satu orbital p tetap tak terhibridisasi.
1.3
Hibridisasi sp
Hibridisasi
sp digunakan bila karbon membentuk ikatan rangkap tiga. Untuk membentuk orbital
ikatan sp karbon menghibridisasi orbital 2enya hanya dengan satu orbital 2pnya.
Dua orbital p tetap tak terhibridisasi.
2. ORBITAL
HIBRIDA NITROGEN
Semua
ikatan kovalen yang dibentuk oleh unsur unsur dapat dijelaskan dengan orbital
hibrida. Secara prinsip pembentukkan hibrida sama dengan atom karbon. Atom
nitrogen mempunyai konfigurasi ground state 1s2, 2s2, 2px1,
2py1, 2pz1. Atom nitrogen mengalami
hibridisasi sebagai berikut
a. Atom
nitrogen mengalami hibridisasi sp3. Pada hibridisasi sp3,
satu orbital sp3 diisi oleh sepasang elektron dan tiga orbital sp3
diisi oleh satu elektron.
b. Ikatan
rangkap dua terbentuk ketika satu elektron dalam orbital hibrida nitrogen
tereksitasi ke orbital p maka terbentuk hibrida baru yaitu sp2.
Elektron pada orbital p ini digunakan untuk membentuk ikatan pi. Jadi, atom
nitrogen yang terhibridisasi sp2 memiliki satu ikatan pi yang
ddigunakan untuk membentuk ikatan rangkap dua, mirip dengan molekul etena.
c. Jika
elektron yang tereksitasi ke orbital p ada dua, maka nitrogen memiliki kemampuan
membentuk dua ikatan pi dan satu ikatan σ sp membentuk ikatan rangkap tiga.
3. ORBITAL
HIBRIDA OKSIGEN
Atom
oksigen memiliki konfigurasi elektron valensi ground state 2s2, 2px1,
2py1, 2pz1. Seperti karbon dan
hidrogen. Oksigen membentuk ikatan dengan orbital hibrida sp3 .
Air
adalah contoh senyawa yang mengandung oksigen sp3. Sudut ikatan
dalam air adalah 104,5o. Diperkirakan bahwa orbital dengan
elektron menyendiri menekan sudt ikatan H-O-H, seperti halnya orbital terisi
dalam amonia menekan sudut ikatan H-N-H.
4. IKATAN
RANGKAP TERKONYUGASI
Molekul
organik dapat mengandung lebih dari satu gugus fungsi. Beberapa diantaranya
senyawa dengan ikatan rangkap karbon-karbon lebih dari satu.
Ada dua cara pokok
menempatkan ikatan rangkap dalam senyawa organik:
a. Ikatan
rangkap terkonyugasi atau terdelokasi.
b. Ikatan
rangkap tak terkonyugasi atau terdelokasi.
2.5 Teori Tolakan
Pasangan Elektron Valensi
Konsep
yang dapat menjelaskan bentuk geometri (struktur ruang) molekul dengan
pendekatan yang tepat adalah Teori Tolakan Pasangan Elektron Valensi ( Valence
Shell Electron Pair Repulsion= VSEPR). Teori ini disebut juga Teori Domain
Elektron. Teori ini dapat menjelaskan ikatan antar atom dari PEB dan PEI yang
kemudian dapat mempengaruhi bentuk molekul. Teori VSPER adalah suatu model
kimia yang digunakan untuk menjelaskan bentuk bentuk molekul kimiawi
berdasarkan gaya tolakan elektrostatik antar pasangan elektron. Teori ini juga
dinamakan teori Gillespie-Nhylom, dinamai atas dua orang pengembang teori ini.
Dalam teori ini dinyatakan bahwa “pasangan elektron terikat dan pasangan
elektron bebas, yang secara kovalen digunakan secara bersama-sama diantara atom
akan saling menolak, sehingga pasangan itu akan menempatkan diri sajauh-jauhnya
untuk meminimalkan tolakan”.
Teori
VSEPR pertama kali dikembangkan oleh ahli kimia dari Kanada, R.J.Gillespie
1957. Bentuk molekul dan strukturnya dapat diramalkan dengan tepat melalui
struktur Lewis. Struktur ini dapat menggambarkan bagaimana elektron tersusun
pada suatu atom yang berikatan.
Teori
VSERPR tidak menggunakan orbital atom dalam meramalkan bentuk molekul atom
dalam meramalkan bentuk molekul, tetapi menggunakan titik elektron suatu atom.
Jika suatu atom bereaksi, maka elektron pada kulit terluar (elektron valensi)
akan berhubungan langsung terlebih dahulu. Elektron valensi akan menentukan
bagaimana suatu ikatan dapat terjadi.
Teori
VSEPR menjelaskan terjadinya gaya tolak-menolak
antar pasangan-pasangan elektron pada kulit terluar atom pusat. Teori VSEPR
berhasil menjelaskan bentuk molekul. Ketetapan gaya prediksi teori VSEPR
relatif sangat tinggi, khususnya untuk molekul-molekul yang pusatnya atom
non-logam.
BAB III
PENUTUP
3.1
Simpulan
·
Kemampuan bergabung
dengan atom lain untuk membentuk senyawa, dalam setiap senyawa atom-atom
terjalin secara terpadu oleh suatu bentuk ikatan antar atom yang disebut ikatan
kimia
·
Hibdrisasi adalah
sebuah konsep bersatunya orbital orbital atom membentuk orbital hibrid yang
baru yang sesuai dengan penjelasan kualitatif sifat ikatan atom.
·
Teori VSPER adalah
suatu model kimia yang digunakan untuk menjelaskan bentuk bentuk molekul
kimiawi berdasarkan gaya tolakan elektrostatik antar pasangan elektron.
3.2
Saran
Saran penulis terhadap para pembaca
agar para pembaca lebih cermat dan teliti dalam memahami apa yang terdapat
dalam isi makalah ini. Dan penulis berharap pembaca mampu memberi kritik atau
komentar atas kekurangan yang ada di dalam makalah ini.
DAFTAR PUSTAKA
Agus,
Kamaludin. 2010. Cara Cepat Kuasai Konsep
Kimia SMA Kelas X. Yogyakarta: CV. Andi Offset
Chang,
Raymond. 2004. Kimia Dasar Konsep-Konsep
Inti. Jakarta: Erlangga
Fatisa,
Yuni. 2014. Kimia Organik I.
Pekanbaru: Kreasi Edukasi
Ismunandar.
2011. Pengantar Kimia. Jakarta:
Erlangga.
Isnaeni,
Imam Sidiq. Sains Kimia. Jakarta:
Erlangga
Khamidinal.
2009. Kimia SMA/MA Kelas X. Jakarta:
Pusat Perbukuan
Lestari,
Sri. 2003. Kumpulan Rumus Kimia SMA.
Jakarta: Kawan Pustaka
Michael Wesberg. 2010.
Challanges To The Structural Conception of Chemical Bonding. Diunduh pada
tanggal 26 September 2015
Riswiyanto.
2009. Kimia Organik. Jakarta:
Erlangga
Sastrohamidjojo,
Hardjono. 2011. Kimia Organik Dasar.
Yogyakarta: UGM
Sugiyarto,
Kristian H. 2012. Dasar-Dasar Kimia
Anorganik Transisi. Yogyakarta: Graha Ilmu
Sunarya,
Yayan.2010. Kimia Dasar I Berdasarkan Prinsip-Prinsip Kimia Terkini. Bandung:
Yrama Widya
Syukri,
S. 1999. Kimia Dasar I. Bandung: ITB
Wilbraham,
Antony C dan Michael S. Matta. 1992. Kimia
Organik dan Hayati. Bandung: ITB
Woro Sumarni.
2010. Penerapan Learning Cycle Appoach Sebagai Upaya Meminimalisir Miskonsepsi
Mahasiswa Pada Materi Struktur Molekul. Vol.2 Nomer 4. Diunduh pada tanggal 27
September 2015
[1]
Khamidinal, Kimia SMA/MA kelas X. Pusat
Perbukuan, Jakarta, 2009. Hlm
32
[2] Ismunandar,
Pengantar Kimia. Erlangga. Jakarta,
2011. Hlm 41
[3] Ibid. Hlm: 42-43
[4] Michael
Weisberg, Challenges to the Structural
Conception of Chemical Bonding 2010. Hlm 4
[5] Ismunandar,
Pengantar Kimia. Erlangga. Jakarta,
2011 hlm 44
[6]
Isnaeni, Imam Sidiq.Sains Kimia. Hlm
25-26
[7] Ismunandar,
Pengantar Kimia. Erlangga. Jakarta,
2011 hlm 45-46
[8]
Isnaeni, Imam Sidiq.Sains Kimia. Hlm
28
[9] Ismunandar,
Pengantar Kimia. Erlangga. Jakarta,
2011 hlm 47
[10]
Ibid. hlm 48
[11]
Ibid. hlm 49-50
[12]
Ibid.53-54
[13]
Ibid hlm 57
[14] Syukri. Kimia Dasar 1. Hlm: 213-214
[15] Kristian H. Sugiyarto. Dasar-Dasar Kimia
Anorganik Transisi. 2012. Hlm: 116-120
[16] Raymond Chang. Kimia Dasar Konsep-Konsep
Inti. 2006. Hlm: 264-266
[17] Prof. Dr. Hardjono Sastrohamidjojo. Kimia
Organik Dasar. 2011. Hlm: 9-14
[18] Yayan Sunarya. Kimia Dasar 1. Hlm 449-459
[19] Drs. Riswiyanto. Kimia Organik. 2009. Hlm:
13
[20] Ibid. Hlm: 14
[21] Yuni Fatisa. Kimia Organik 1. Hlm: 34
Tag : struktur molekul dna, struktur molekul protein, struktur molekul lemak, struktur molekul asam amino, struktur molekul glukosa, struktur molekul air, struktur molekul fruktosa, struktur molekul rna, struktur molekul raksasa, struktur molekul nitrat, struktur molekul alkohol, struktur molekul amilum, struktur molekul asam asetat, struktur molekul aseton, struktur molekul aspirin, struktur molekul alkana, struktur molekul asam sitrat, struktur molekul asam benzoat, struktur molekul benzena, struktur molekul butana, struktur molekul berdasarkan teori orbital molekul, struktur molekul beta karoten, struktur molekul basitrasin, struktur molekul bensin, struktur molekul boraks, struktur molekul benzaldehid, struktur molekul bromtimol biru, struktur molekul bf3, struktur molekul co, struktur molekul kumarin, struktur molekul co2, struktur molekul ch4, struktur molekul cmc, struktur molekul c4h10o, struktur molekul ch3cooh, struktur molekul cfc, struktur molekul caco3, struktur molekul c2h6, struktur molekul dipropil eter, struktur molekul dari 2 pentena, struktur molekul disakarida, struktur molekul dna dan rna, struktur molekul dari 3 metil heksana, struktur molekul dipropil keton, struktur molekul detergen, struktur molekul d-glukosa, struktur molekul dna menurut watson dan crick, struktur molekul etanol, struktur molekul eter, struktur molekul ester, struktur molekul es, struktur molekul metilen klorida, struktur molekul edta, struktur molekul etil asetat, struktur molekul etena, struktur molekul enzim, struktur molekul ebt, struktur molekul fenol, struktur molekul flavonoid, struktur molekul formaldehida, struktur molekul fosfor, struktur molekul fosfolipid, struktur molekul fenolftalein, struktur molekul fitosterol, struktur molekul fruktan, struktur molekul fenilalanin, struktur molekul galaktosa, struktur molekul gelatin, struktur molekul garam diazonium, struktur molekul giberelin, struktur molekul garam, struktur molekul glikogen, struktur molekul gliserol, struktur molekul gas, struktur molekul glisin, struktur molekul h2o, struktur molekul h2 dan h2o, struktur molekul hcn, struktur molekul hormon fsh, struktur molekul hidrokarbon, struktur molekul hormon estrogen, struktur molekul haloalkana, struktur molekul h2co3, struktur molekul hemoglobin, struktur molekul h2so4, struktur molekul isobutanol, struktur molekul isoprena, struktur molekul intan, struktur molekul insulin, struktur molekul iga, struktur molekul intan dan grafit, struktur molekul imunoglobulin, struktur molekul isopropil alkohol, struktur molekul igg, struktur molekul ibuprofen, struktur molekul minyak jagung, struktur molekul asam lemak jenuh, jurnal struktur molekul, jelaskan struktur molekul rna dilihat dari rantainya, jenis struktur molekul, struktur molekul karbohidrat, struktur molekul kimia, struktur molekul kolesterol, struktur molekul kafein, struktur molekul kolagen, struktur molekul klindamisin, struktur molekul keton, struktur molekul keramik, struktur molekul karbon dioksida, struktur molekul klorofil, struktur molekul laktosa, struktur molekul lemak dan asam lemak, struktur molekul lipid, struktur molekul likopen, struktur molekul lewis, struktur molekul leusin, struktur molekul likopen dengan struktur molekul β-karoten, struktur molekul ligan oksalat, struktur molekul linear, struktur molekul monosakarida, struktur molekul monomer, struktur molekul maltosa, struktur molekul monomer dari polimer pvc, struktur molekul madu, struktur molekul miofilamen, struktur molekul monomer dari polimer polietilena, struktur molekul msg, struktur molekul metana, struktur molekul mineral, struktur molekul nh3, struktur molekul naoh, struktur molekul no2, struktur molekul nitrogen, struktur molekul nacl, struktur molekul naftalena, struktur molekul natrium klorida, struktur molekul n-heksana, struktur molekul n-dekana, struktur molekul n-heptana, struktur molekul n-pentana, struktur molekul organik, struktur molekul omega 6, struktur molekul ortofenantrolin, struktur molekul o2, struktur molekul ozon, struktur molekul oktahedral, struktur molekul oksigen, struktur molekul obat, struktur molekul oligosakarida, struktur organisasi molekul, struktur molekul pvc, struktur molekul pdf, struktur molekul pcl5, struktur molekul ppt, struktur molekul polisakarida, struktur molekul parafin, struktur molekul polistirena, struktur molekul polimer, struktur molekul parasetamol, struktur molekul raksasa dimiliki oleh, struktur molekul rna dan dna, struktur molekul raksasa dimiliki oleh unsur, struktur molekul rhodamin b, struktur molekul rna dilihat dari rantainya, struktur molekul rafinosa, struktur molekul ribosa, struktur molekul riboflavin, struktur molekul senyawa, struktur molekul sabun, struktur molekul sukrosa, struktur molekul safrol, struktur molekul selulosa, struktur molekul so3, struktur molekul so2, struktur molekul senyawa haloalkana, struktur molekul sabinena, struktur molekul saponin, struktur molekul, struktur molekul tanin, struktur molekul tnt, struktur molekul teflon, struktur molekul tristearat, struktur molekul titik didih paling tinggi, struktur molekul titik didih paling rendah, struktur molekul trimiristin, struktur molekul trna, struktur molekul tween 80, struktur molekul trigliserida, struktur molekul urea, struktur molekul unsur, struktur molekul unsur dan molekul senyawa, struktur molekul uap air, struktur umum molekul asam amino, struktur umum molekul asam amino dan protein, struktur umum molekul protein, struktur umum molekul lemak, struktur molekul dna untai ganda, struktur molekul asam urat, struktur molekul vitamin, struktur molekul vitamin b, struktur molekul vitamin e, struktur molekul vitamin c, struktur molekul vitamin b2, struktur molekul vitamin b3, struktur molekul vitamin b12, struktur molekul vitamin b1, struktur molekul vitamin b6, struktur molekul vitamin b5, struktur molekul wikipedia, struktur molekul zat warna, struktur molekul zat warna direk, struktur molekul xef4, struktur molekul xanthan gum, struktur molekul xef2, struktur molekul xylan, struktur molekul xef6, struktur molekul yang mempunyai titik didih paling rendah, struktur molekul yang memiliki ribozyme, struktur molekul yang termasuk senyawa haloalkana adalah, struktur molekul yang menunjukkan isomeri 2-metil-2-butena adalah, struktur molekul yang memiliki titik didih paling rendah, struktur molekul yang mempunyai titik didih tinggi, struktur molekul yang mempunyai titik didih tertinggi, struktur molekul yang membedakan asam amino, struktur molekul senyawa yang termasuk karbohidrat, struktur molekul asam amino yang mengandung inti benzena, struktur molekul zat karbohidrat, struktur molekul zat cair, struktur molekul zeolit, struktur molekul air zam-zam, struktur molekul 2 pentena, struktur molekul 2 2 dimetil 1 metoksi propana, struktur molekul 20 asam amino, struktur molekul 2-propanol, struktur molekul glisin pada ph 2.34 dan ph 9 6, struktur molekul 3 metil heksana, struktur molekul periode 3, rangkaian struktur 3 molekul nukleotida rna, struktur 3 dimensi molekul dna