Download Disini Makalahnya lebih Rapi dan Lengkap Dengan Gambar
Note :
- Cara Download Tunggu Selama 5 Detik Kemudian Klik Skip di Pojok Kanan
- Jika Link Download Buku tidak aktif lagi silahkan PM Admin di email shirosora02@gmail.com maupun difacebook facebook.com/shirosora
BAB IV
ANALISIS KUALITATIF PROTEIN
TUJUAN :
- Mengetahui prinsip dasar uji kualitatif protein
- Mengetahui perbedaan prinsip dari masing-masing metode
A. Pre-lab
1. Bagaimana prinsip
analisis protein dengan metode ninhidrin?
Ninhidrin
adalah pereaksi yang digunakan secara luas untuk mengukur asam amino secara
kuantitatif. Pereaksi itu bereaksi dengan hampir semua asam amino,
menghasilkan senyawa bewarna lembayung (prolina memberikan warna kuning)
(Apriandi, 2011).
|
2. Bagaimana prinsip
analisis protein dengan metode biuret?
Pembentukan kompleks Cu2+ dengan gugus –CO dan –NH dari rantai peptida
dalam suasana basa. Uji ini untuk menunjukkan adanya senyawa-senyawa yang
mengandung gugus amida asam yang berada bersama gugus amida yang lain. Uji
ini memberikan reaksi positif yaitu ditandai dengan timbulnya warna merah
violet atau biru violet (Hidayatullah, 2012).
|
3. Mengapa
pengujian protein selalu dilakukan pada kondisi alkali/basa?
Sebenarnya
protein bersifat amfoter, bisa bereaksi dengan asam atau basa. Namun lebih
mudah bereaksi dengan suasana basa, selain itu agar mudah untuk diamati.
Dalam uji biuret, supaya ion Cu2+ dari pereaksi biuret (dalam suasana basa)
akan bereaksi dengan polipeptida atau ikatan- ikatan peptida yang menyusun
protein membentuk senyawa kompleks berwarna ungu atau violet (Hidayatullah,
2012).
|
B. Tinjauan
Pustaka
1.
Protein
Protein adalah nutrisi dan bagian dari kehidupan yang
sangat penting. Protein merupakan komposisi terbesar pembentuk dari tubuh.
Protein dibentuk dari rantai panjang asam amino yang berbeda-beda. Protein
berfungsi sebagai pembentuk sel-sel di dalam tubuh, membantu pertumbuhan,
memperbaharui sel-sel yang lama dan memperbaiki sel-sel yang telah rusak
(Begeman, 2007).
2.
Uji Ninhidrin
Terjadinya larutan berwarna biru menunjukkan
reaksi positif terhadap adanya asam amino (Apriandi, 2011).
3.
Uji Biuret
Protein dibuat alkalis dengan NaOH kemudian ditambahkan
larutan CuSO4 encer. Uji ini untuk menunjukkan adanya senyawa senyawa yang mengandung
gugus amida asam yang berada bersama gugus amida yang lain. Uji ini memberikan
reaksi positif yaitu ditandai dengan timbulnya warna merah violet atau biru
violet. (Apriandi, 2011).
4.
Fungsi Reagen
a.
Reagen
Ninhidrin
Ninhidrin sebagai suatu oksidator yang kuat
dapat menyebabkan terjadinya dekarboksilasi oksidatif asam α-amino untuk
menghasilkan suatu aldehid dengan atom karbon kurang asam amino induknya.
Senyawa ini merupakan hidrat dari triketon siklik, dan bila bereaksi dengan
asam amino menghasilkan zat berwarna ungu (Hidayatullah, 2012).
b.
Reagen Biuret
Reagen Biuret dibuat dari KOH/NaOH dan tembaga(II) sulfat
hidrat, bersama dengan kalium natrium tartrat. Kalium natrium tartrat
ditambahkan untuk kompleks dan menyetabilkan ion kupri. Reagen berubah dari
biru ke ungu dengan adanya protein, biru ke merah jambu (pink) ketika bergabung
dengan polipeptida rantai-pendek (Rajvaidya, 2005).
5.
Tinjauan Bahan
a.
Gelatin
Gelatin adalah polipeptida dengan berat molekul tinggi
dan hidrokoloid penting yang telah terbukti secara umum dan penggunaannya dalam
berbagai makanan untuk meningkatkan
elastisitas, konsistensi, dan stabilitas seperti gel. Gelatin berbeda dari hidrokoloid lain karena kebanyakan dari
mereka adalah polisakarida, sedangkan gelatin adalah protein yang dapat dicerna
dan mengandung semua asam amino esensial kecuali triptofan. Komposisi asam
amino khususnya yang berkaitan dengan prolin dan hidroksiprolin dapat
bervariasi dari spesies ke spesies, sebagai akibat dari paparan berbagai
kondisi lingkungan, khususnya suhu. Gelatin
dapat diperoleh tidak hanya dari kulit dan tulang hewan darat, tetapi juga dari
ikan dan serangga (Mariod, 2013).
b.
Susu skim
Susu skim dibuat ketika semua krim (juga disebut lemak
susu) dihapus dari susu. Kadang-kadang, hanya setengah krim dihapus, sehingga
susu semi-skim gantinya. Susu skim lebih populer di Amerika Serikat daripada
Inggris. Ini mengandung lemak kurang dari susu biasa, yang berarti bahwa banyak
ahli gizi dan dokter menyarankan untuk orang-orang yang mencoba untuk
menurunkan berat badan atau mempertahankan berat badan yang sehat. Susu skim
cenderung memiliki rasa sedikit berair, yang beberapa konsumen tidak menikmati.
Susu rendah lemak memiliki tingkat lemak antara 0,5-2% Hal ini juga harus
berisi minimal 8,25% padatan-tidak-lemak. Ini harus berisi 2.000 IU vitamin A
per liter. Susu skim juga disebut susu non fat (Wolke, 2005).
c.
MSG
Monosodium
glutamat (MSG) adalah garam natrium (sodium) dari asam glutamat, suatu asam
amino yang terdapat dalam semua jenis protein. Glutamat diproduksi melalui fermentasi,
suatu proses yang digunakan untuk membuat bir, cuka, kecap kedelai dan yogurt.
Prosesnya dimulai dengan bahan alami seperti tetes gula (molasses) dari gula
tebu atau gula bit dan pati singkong atau biji-bijian. MSG berfungsi sebagai
bahan penyedap dan penambah cita rasa dalam makanan (Husarova, 2013).
d.
Aspartam
Aspartam adalah pemanis nutritif yang memasok energi
tubuh dalam bentuk kalori. Aspartam seratus hingga dua ratus kali lebih manis
daripada sukrosa. Bahan ini terdiri atas kombinasi dua protein, asam aspartat
dan fenilalanin (Wolke, 2005).
C. Diagram Alir
1.
Uji Ninhidrin
|
Tabung reaksi
|
Disiapkan sejumlah tabung reaksi sesuai dengan jumlah
sampel
Diberi label sesuai dengan nama sampel
|
2 ml larutan ninhidrin
|
|
2 ml sampel
|
Dimasukkan tabung reaksi ke dalam air mendidih selama
15-20 detik
Diamati warna larutan
Dicatat hasil pengamatan pada data hasil pengamatan
|
Hasil
|
2.
Uji Biuret
|
Tabung reaksi
|
Disiapkan sejumlah tabung reaksi sesuai dengan jumlah
sampel
Diberi label sesuai dengan nama sampel
|
1 ml NaOH 10%
|
|
3 ml sampel
|
Dikocok
|
3 tetes larutan CuSO4 0,1%
|
Diamati timbulnya warna
Dicatat hasil pengamatan pada data hasil pengamatan
|
Hasil
|
D. Data Hasil Percobaan Dan Pengamatan :
1. Uji Ninhidrin
a.
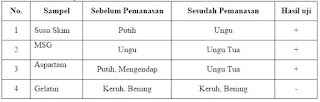
Tuliskan data hasil uji Ninhidrin
No.
|
Sampel
|
Sebelum
Pemanasan
|
Sesudah
Pemanasan
|
Hasil uji
|
1
|
Susu Skim
|
Putih
|
Ungu
|
+
|
2
|
MSG
|
Ungu
|
Ungu Tua
|
+
|
3
|
Aspartam
|
Putih, Mengendap
|
Ungu Tua
|
+
|
4
|
Gelatin
|
Keruh, Bening
|
Keruh, Bening
|
-
|
b. Bahas dan bandingkan data-data hasil uji
Ninhidrin dari beberapa sampel dalam percobaan ini!
Tujuan dari uji ninhidrin adalah untuk
mengetahui jumlah asam bebas pada suatu sampel. Prinsipnya adalah menguji tada
tidaknya protein dalam suatu senyawa dengan penambahan reagen ninhidrin untuk
mengetahui jumlah kadar asam amino bebas yang terkandung didalamnya dimana asam
amino bebas akan bereaksi dengan ninhidrin membentuk senyawa kompleks warna
ungu. Pemanasan dalam reaksi ini bertujuan untuk mempercepat reaksi yang
terjadi.
Reaksi atau mekanisme yang terjadi adalah
reaksi yang memicu terjadinya warna biru pekat atau ungu adalah proses reduksi
reagen ninhidrin oleh asam α-amino. Asam α-amino akan terpecah karena adanya
reduksi dari asam amino dan terbentuklah ninhidrin tereduksi, aldehid dan NH3
disertai dengan terlepaskannya gas CO2. Selanjutnya terjadi reaksi
antara ninhidrin tereduksi dengan amonia sehingga akan terjadi proses kondensasi
yang melepaskan molekul H2O dan menghasilkan garam
diketo–hyrilhalide–diketo–hydramine berwarna ungu.
(Petsko, 2005)
Analisa
prosedur
Pertama mempersiapkan alat dan bahan yang
digunakan dalam percobaan, antara lain empat tabung reaksi, kertas label,
penangas air, gelas beker 500 ml, labu penghisap atau bulb, empat pipet ukur 1
ml, gelas ukur 10 ml dan rak tabung reaksi, kemudian bahan yang dibutuhkan
adalah reagen ninhidrin, larutan susu skim (10%), monosodium glutamate (5%),
gelatin (5%), dan aspartame.
Setelah semua alat dan bahan siap,
kemudian melabeli alat yang digunakan seperti tabung reaksi dan pipet ukur
sesuai dengan nama sampel yang diujikan supaya tidak tertukar dan/atau
tercampur antara sampel yang satu dengan sampel lainnya. Setelah pelabelan,
kemudian dilanjutkan dengan mengambil 2 ml sampel menggunakan masing-masing
pipet ukur dan dimasukkan kedalam tabung reaksi sesuai dengan label namanya.
Sebelum mengambil, sampel sebaiknya dikocok atau dihomogenkan kembali supaya
larut secara merata dan tidak terdapat endapan yang dapat mempengaruhi hasil
percobaan, khusus untuk susu skim diambil dengan menggunakan gelas ukur 10 ml
karena apabila diambil dengan menggunakan pipet ukur dapat menyumbat saluran
pipet ukur dan mengakibatkan kerusakan. Setelah sampel diambil dan dimasukkan
ke dalam masing-masing tabung reaksi, kemudian ditambahkan 2 ml larutan
ninhidrin. Diamati perubahan warna yang terjadi sebelum pemanasan kemudian
hasilnya dicatat. Setelah dicatat kemudian dimasukkan ke dalam penangas air
atau gelas beker yang berisi air mendidih selama 15-20 detik. Kembali mengamati
perubahan warna yang terjadi dan mencatat hasilya pada data hasil pengamatan.
Sampel yang berubah warna menjadi berwarna ungu menandakan bahwa terdapat
kandungan asam amino bebas didalamnya (uji positif), sementara yang tidak
berubah warna atau tetap maka uji negatif dengan kata lain tidak terdapat
kandungan asam amino bebas.
Ninhidrin berfungsi sebagai pereaksi yang
digunakan untuk menguji kandungan asam amino bebas didalam sampel.
Analisa
Hasil
Sampel pertama berupa susu skim, berwarna
putih saat ditambahkan reagen ninhidrin sebelum dipanaskan. Setelah dilakukan
pemanasan, warna sampel berubah menjadi berwarna ungu yang menandakan bahwa
terjadi reduksi reagen ninhidrin oleh asam α-amino. Reaksi uji sampel pertama
positif yang menandakan adanya kandungan asam amino bebas didalamnya.
Sampel kedua berupa MSG, langsung
berwarna ungu saat ditambahkan reagen ninhidrin sebelum dipanaskan. Setelah
dilakukan pemanasan, warna sampel berubah menjadi berwarna ungu tua yang
menandakan bahwa terjadi reduksi reagen ninhidrin oleh asam α-amino. Reaksi uji
sampel kedua positif yang menandakan adanya kandungan asam amino bebas
didalamnya.
Sampel ketiga berupa aspartam, berwarna
putih dan terdapat endapan dibawah tabung reaksi saat ditambahkan reagen
ninhidrin sebelum dipanaskan. Setelah dilakukan pemanasan, warna sampel berubah
menjadi berwarna ungu yang menandakan bahwa terjadi reduksi reagen ninhidrin
oleh asam α-amino. Reaksi uji sampel ketiga positif yang menandakan adanya
kandungan asam amino bebas didalamnya.
Sampel keempat berupa gelatin, berwarna
keruh transparan saat ditambahkan reagen ninhidrin sebelum dipanaskan dan
setelah dilakukan pemanasan, warna larutan gelatin tetap keruh transparan, ini
menandakan bahwa didalam gelatin tidak terdapat asam α-amino bebas sehingga
tidak terjadi reaksi reduksi reagen ninhidrin oleh asam α-amino. Reaksi uji
sampel keempat negatif yang menandakan tidak terdapat kandungan asam amino
bebas didalamnya.
2.
Uji Biuret
a. Tuliskan data hasil uji Biuret
No.
|
Sampel
|
Sebelum
ditambah reagen
(Sampel +
NaOH)
|
Sesudah
ditambah reagen
(Sampel + NaOH
+ CuSO4)
|
Hasil uji
|
1
|
Susu skim
|
Bening keruh
|
Keruh
|
-
|
2
|
MSG
|
Bening
|
Bening
|
-
|
3
|
Gelatin
|
Bening Kekuningan
|
Ungu pada
permukaan
|
+
|
4
|
Aspartam
|
Bening
|
Bening
|
-
|
b. Bahas dan bandingkan data-data hasil uji Biuret dari beberapa
sampel dalam percobaan ini!
Tujuan
dari uji Biuret adalah untuk mengetahui ada tidaknya protein didalam senyawa
berdasarkan ikatan peptida. Prinsip dari uji Biuret adalah menguji ada tidaknya
protein dalam suatu senyawa dengan penambahan NaOH dan CuSO4
berdasarkan ada tidaknya ikatan peptida dengan Cu2+
didalam suasana basa akan bereaksi dengan ikatan-ikatan peptida yang menyusun
protein dan membentuk senyawa kompleks ungu. Reaksi ini beraksi positif
terhadap dua buah atau lebih ikatan peptida tetapi negati terhadap asam amino
bebas.
Analisa Prosedur
Pertama mempersiapkan alat dan bahan yang
digunakan dalam percobaan, antara lain empat tabung reaksi, kertas label, labu
penghisap atau bulb, empat pipet ukur 1 ml, pipet volume 10 ml, pipet tetes,
gelas ukur 10 ml dan rak tabung reaksi, kemudian bahan yang dibutuhkan adalah
reagen Biuret (CuSO4), larutan NaoH, larutan susu skim (10%),
monosodium glutamate (5%), gelatin (5%), dan aspartame.
Setelah
semua alat dan bahan siap, kemudian melabeli alat yang digunakan seperti tabung
reaksi dan pipet ukur sesuai dengan nama sampel yang diujikan supaya tidak
tertukar dan/atau tercampur antara sampel yang satu dengan sampel lainnya.
Setelah pelabelan, kemudian dilanjutkan dengan mengambil 3 ml sampel
menggunakan masing-masing pipet ukur dan dimasukkan kedalam tabung reaksi
sesuai dengan label namanya. Sebelum mengambil, sampel sebaiknya dikocok atau
dihomogenkan kembali supaya larut secara merata dan tidak terdapat endapan yang
dapat mempengaruhi hasil percobaan, khusus untuk susu skim diambil dengan
menggunakan gelas ukur 10 ml karena apabila diambil dengan menggunakan pipet
ukur dapat menyumbat saluran pipet ukur dan mengakibatkan kerusakan. Setelah
sampel diambil dan dimasukkan ke dalam masing-masing tabung reaksi, kemudian
ditambahkan 1 ml NaOH 10% dan dikocok. Diamati perubahan warna yang terjadi
sebelum ditambahkan reagen biuret kemudian dicatat hasilnya. Selanjutnya
ditambahkan 1 sampai 3 tetes larutan CuSO4 0,1% dan kembali
mengamati perubahan warna yang terjadi serta mencatatnya. Sampel yang berubah
warna menjadi berwarna ungu menandakan bahwa terdapat kandungan ikatan peptida
lebih dari dua didalamnya (uji positif), sementara yang tidak berubah warna
atau tetap maka uji negatif dengan kata lain tidak terdapat kandungan ikatan
peptida.
NaOH
pada percobaan ini berfungsi untuk menciptakan suasana basa sementara CuSO4
atau reagen biuret digunakan membentuk senyawa kompleks ungu.
Analisa Hasil
Pada percobaan Uji Biuret kali ini,
ternyata setiap sampel memiliki reaksi yang berbeda-beda terhadap reagen biuret
(CuSO4). Pada sampel susu skim tidak menghasilkan warna ungu bening yang
berarti hasil uji negatif (-), pada susu skim seharusnya mengandung ikatan
peptida (Rosenberg, 2006), namun pada percobaan ini tidak menunjukan hal
tersebut ditandai dengan terbentuknya cincin ungu pada permukaan, ini dapat
terjadi karena kurangnya CuSO4 yang diteteskan pada sampel atau
protein pada sampel telah rusak oleh denaturasi. Pada sampel MSG menghasilkan
warna biru bening yang berarti memiliki hasil uji negatif (-) yaitu MSG tidak
mengandung ikatan peptida pada sampel protein. Pada sampel aspartam
menghasilkan warna biru bening yang berarti memiliki hasil uji negatif (-)
yaitu aspartam tidak mengandung ikatan peptida pada sampel protein. Pada sampel
gelatin menghasilkan warna ungu kemerahan yang berarti memiliki hasil uji
positif (+) yaitu gelatin mengandung ikatan peptida pada sampel protein
(Rosenberg, 2006).
PERTANYAAN
1. Bagaimana mengidentifikasi
adanya gugus amino pada sampel dengan menggunakan uji Ninhidrin?
Dengan
memasukkan reagen ninhidrin pada sampel, karena asam amino akan bereaksi dengan
ninhidrin dan membentuk senyawa kompleks berwarna ungu. Sehingga indikasi
adanya asam amino ditunjukkan oleh perubahan warna sampel pada saat sesudah
direaksikan dan dipanaskan, yakni apabila ia mengandung asam amino makan akan
berwarna ungu. Namun ada juga yang tanpa dipanaskan sudah menghasilkan warna
ungu, misalnya MSG (Dyah, 2011).
2.
Bagaimana reaksi yang
terjadi antara sampel dengan reagen pada uji Biuret?
Pada prinsip kerja biuret, yaitu menguji ada
atau tidak adanya protein dalam suatu senyawa dengan penambahan reagen NaOH dan
CuSO4 berdasarkan ada atau tidaknya ikatan peptida (ikatan peptida
harus 2 atau lebih). Dimana ion Cu2+
(dari pereaksi biuret) dalam suasana basa akan bereaksi dengan polipeptida yang
menyusun protein dan membentuk senyawa kompleks berwarna biru hingga ungu. Setelah direaksikan dengan sampel, warna
yang terbentuk mudah pudar, hal ini dikarenakan ion Cu2+ mengikat 2 ikatan
peptida dan jika lama dibiarkan ikatan tersebut semakin lemah (tidak stabil)
sehingga itu yang menyebabkan warnanya jika dibiarkan lama akan memudar
(Agustin, 2010).
KESIMPULAN
Tujuan dari praktikum uji kualitatif protein adalah pertama untuk
mengetahui prinsip dasar uji kualitatif protein dan yang ke dua untuk
mengetahui perbedaan prinsip dari masing-masing metode.
Prinsip Uji Ninhidrin adalah menguji ada tidaknya asam α amino
bebas pada sampel protein dengan mereaksikannnya dengan reagen ninhidrin
sehingga membentuk senyawa kompleks bewarna ungu. Reaksi yang terjadi pada uji
ninhidrin terhadap sampel adalah reagen ninhidrin dengan asam α amino bebas
membentuk senyawa kompleks bewarna ungu karena asam α amino mereduksi reagen
ninhidrin. Mekanisme Uji Ninhidrin adalah ninhidrin bereaksi dengan asam amino
sampel dan akan tereduksi, kemudian melepas oksigen sehingga menghasilkan
ninhidrin tereduksi CO2, NH3, dan aldehid. Sisa dari
ninhidrin akan bereaksi dengan amonia dan ninhidrin tereduksi membentuk senyawa
kompleks bewarna ungu (garam diketohyrilhalide) dan (diketohydramine). Prinsip
Uji Biuret adalah menguji ada tidaknya ikatan peptida pada suatu sampel
protein. Caranya mereaksikannya dengan CuSO4 (reagen biuret) dalam
suasana basa. Reaksi yang terjadi adalah ikatan-ikatan peptida yang menyusun
protein bereaksi dengan CuSO4 (Cu2+) dan dibantu NaOH
sebagai alkalis akan membentuk senyawa kompleks bewarna ungu. Mekanisme Uji
Biuret adalah uji ini didasarkan pada pembentukan kompleks Cu2+ yang
dihasilkan dari CuSO4 dengan gugus CO dan NH pada ikatan peptida
sampel dalam suasana basa, sehingga menghasilkan senyawa kompleks bewarna ungu.
Hasil dari
percobaan uji kualitatif protein pada Uji Ninhidrin yaitu positif mengandung
asam α amino bebas jika berubah warna menjadi bewarna ungu terdapat tiga sampel
yaitu MSG, Susu skim dan gelatin positif mengandung asam α amino bebas pada
sampel protein. Tetapi tidak dengan aspartam yag menunjukan hasil negatif atau
tidak mengandung asam α amino bebas pada sampel protein. Pada Uji Biuret
bereaksi positif jika terjadi perubahan warna menjadi warna ungu terdapat satu
sampel yaitu gelatin positif mengandung ikatan peptida pada sampel protein.
Tetapi tidak dengan MSG, susu skim dan aspartam yang menunjukan hasil negatif
atau tidak mengandung ikatan peptida pada sampel protein.
DAFTAR PUSTAKA
Apriandi, Azmin. 2011. Aktivitas Antioksidan dan Kompone
Bioaktif Keong Ipong-Ipong (Fasciolaria Salmo). Bogor: Institut Pertanian
Bogor
Begeman, Gale S. 2007. Got Protein?. Arizona: The University
of Arizona
Hidayatullah, Fatih. 2012. Analisa Asam Amino pada Buah Pepaya
dengan Spektrofotometer. Semarang: Universitas Diponegoro
Husarova, Veronika. 2013. Monosodium Glutamate Toxic Effects and
Their
Implications for Human Intake: A
Review. Bratislava:
Comenius University
Mariod, Abdalbasit A., Hadia F. A. 2013. Review: gelatin, source,
extraction and industrial applications. Al-Kamil: King Abdulaziz University
Rajvaidya, Neelima. 2005. Microbiology. New Delhi: APH
Publishing Corporation
Wolke, Robert L. 2005. Kalo Enstein Jadi Koki Sains di Balik
Urusan Dapur. Jakarta: PT. Gramedia Pustaka Utama
DAFTAR PUSTAKA
TAMBAHAN
Agustini, Ni Putu. 2010. Ilmu Kimia Pangan. Denpasar:
Universitas Pendidikan Nasional
Dyah, Roro. 2011. Reaksi Uji
Protein. Makasar : Universitas Hassanudin
Petsko, Gregory A. 2005. Protein Stucture and Function. Sunderland:
New Science Press
Rosenberg, Ian M. 2006. Protein Analysis and Purification. Boston:
Springer
Tag : uji kuantitatif protein metode biuret, uji kuantitatif protein.pdf, uji kuantitatif protein dan asam amino, uji kuantitatif protein metode kjeldahl, uji kuantitatif protein metode bradford, uji kuantitatif protein metode lowry, uji kuantitatif protein dengan metode biuret, uji kuantitatif protein dengan spektrofotometer, uji kuantitatif protein dengan spektrofotometri, uji kuantitatif protein dengan metode lowry, uji kuantitatif protein pdf, uji kuantitatif protein, analisis kuantitatif protein dan asam amino, analisis kuantitatif uji protein, cara uji kuantitatif protein, analisis kuantitatif protein metode biuret, laporan biokimia uji kuantitatif protein, laporan praktikum biokimia uji kuantitatif protein, analisis kuantitatif protein dalam plasma, analisis kuantitatif fraksi protein dalam plasma, uji kualitatif dan kuantitatif protein, dasar teori uji kuantitatif protein, analisis kuantitatif protein metode kjeldahl, uji kuantitatif dan kualitatif protein, uji kuantitatif kadar protein, analisis kuantitatif protein metode lowry, laporan uji kuantitatif protein, laporan analisis kuantitatif protein metode biuret, uji kuantitatif protein pada telur, analisis kuantitatif protein pada susu, analisis kuantitatif protein pdf, uji kuantitatif pada protein, pembahasan uji kuantitatif protein, laporan praktikum uji kuantitatif protein, uji protein secara kuantitatif, uji protein secara kualitatif dan kuantitatif